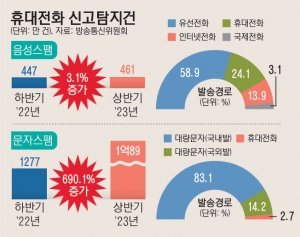
 |
| 국산 31호 신약인 유한양행의 ‘렉라자’. (사진제공=유한양행) |
3년 만에 탄생한 국산 31호 신약 유한양행 ‘렉라자(성분명 레이저티닙)’에 대한 기대가 높아지고 있다. 렉라자 허가 이전 항암제로 허가받은 국산 신약은 6개지만, 성과는 미미했다. 업계는 렉라자가 국산 신약 중 가장 큰 규모의 기술 수출(약 1조4000억원)을 성사시켰던 만큼, 국산 항암제의 역사를 다시 쓸 것으로 기대하고 있다.
21일 관련 업계에 따르면 국산 신약 타이틀을 차지한 항암제는 △SK케미칼 ‘선플라주’(국산 1호) △동화약품 ‘밀리칸주’(국산 3호) △종근당 ‘캄토벨주’(국산 8호) △일양약품 ‘슈펙트’(국산 18호) △젬백스 ‘리아벡스주’(국산 21호) △한미약품 ‘올리타정’(국산 27호)이다.
하지만 현재 매출을 발생시키고 있는 항암제는 극소수에 불과하고, 대부분 시장에서 철수하거나 임상 연구가 중단된 상태다. 1999년 국산 신약 시대를 처음 연 위암 치료제 선플라주는 2009년부터 생산이 중단되며 국산 1호 프리미엄을 누리지 못했다. 간암 치료제 밀리칸주도 동화약품이 시장성이 없다고 판단, 자진 철수했다.
2015년 4월 조건부 허가를 받은 젬백스의 리아백스주는 임상 3상을 진행한 뒤 2020년 3월까지 임상 결과 보고서를 제출하는 조건이었지만, 제출하지 못하면서 지난해 8월 품목허가 취소 처분을 받았다.
한미약품이 야심 차게 개발한 폐암 치료제 올리타정은 2016년 5월 임상 3상 진행을 전제로 조건부 허가를 받으며 국산 신약에 이름을 올렸지만, 2018년 4월 개발이 중단됐다. 임상 연구에서 독성 부작용이 발생한 데다, 기술 수출했던 베링거인겔하임의 계약 해지, 경쟁 약인 아스트라제네카의 3세대 표적항암제 ‘타그리소’의 건강보험 급여 적용 등 복합적인 이유가 작용했다. 이 밖에 난소암 ·폐암 치료제 캄토벨과 백혈병 치료제 슈펙트는 매출 부진을 겪고 있다.
반면, 폐암 치료제 렉라자는 지금까지의 기술 수출 성과를 고려할 때 기존 치료제와는 다른 활약이 기대된다. 1·2세대 EGFR 표적치료제는 내성에 한계가 있지만, 렉라자는 내성에 강한 3세대 치료제라는 점이 강점이다. 하지만, 폐암 치료제 시장을 선점해 올리타정에 쓴맛을 안긴 타그리소와 치열한 경쟁을 펼쳐야 하는 부담도 존재한다.
허혜민 키움증권 연구원은 “렉라자는 올해 하반기부터 약 100억원의 매출이 예상된다”며 “추후 1차 치료제 승인과 아미반타맙 병용 임상 성공 등을 고려하면, 국내 매출 1000억원 이상과 기술 이전 국산 신약 중 처음으로 동급 최고(Best-in-class) 글로벌 블록버스터 약물이 될 것으로 기대한다”고 말했다.
송영두 기자 songzio@viva100.com
 연관검색어
연관검색어